研究背景
药物制剂研究是药学研究中重要的组成部分,同时也是药物从化合物到产品经过的重要环节,它不仅结合了药物和辅料的物理化学性质、药理学活性,还涉及到药物剂型的选择、药物处方设计、制剂工艺的选择以及制剂质量评估,并为药物制剂的产业化生产提供指导,因此药物制剂的研究具有很强的专业性和综合性。由于不同的药物分子结构、理化性质,给药方式,给药途径,释药方式和速度,在体内转运方式以及血药浓度随时间的变化趋势不同,因此药物处方设计与药物制剂的体外释放行为,长期稳定性研究,体内动力学行为及临床疗效等密切相关。随着药学研究的不断发展,对药物制剂处方的要求也越来越高。药物新剂型的出现,制剂技术的创新,药用辅料的发展以及检测方法的完善都为药物制剂的研究提出了新的要求和挑战。目前药物处方设计大多数依旧采用传统方法,即试错方法进行处方筛选、优化及评估,该过程费时且成本较高,极大程度上依赖于实验人员的专业知识和经验,具有很大的不确定性,实验失败率相应增高,研发周期也相应增长,在一定程度上增加了研发成本。因此随着现代药物制剂的发展,为了克服传统试错方法的种种弊端,需要建立更加高效的方法进行处方预测,为药物的制剂研究提供指导[24]。
研究现状
迄今为止,大多数机器学习模型是在相对较小的数据集(<200个样本)上训练的[25-30],使用如此小的数据集会增加训练过程中过拟合的风险,造成在呈现新数据时模型不能很好地泛化。然而,适当的数据拆分策略可以突出过度拟合问题并帮助缓解它们,即使在数据集相对较小的情况下,也会产生更强大的机器学习模型。例如,在某些使用小数据集进行训练的研究中[25, 26],作者采取了预防措施以避免模型过度拟合(即交叉验证和基于多样性的数据拆分,以及提前停止协议)。在其他研究中,采用了基于随机拆分的评估策略[27-30]。在后一种情况下,模型的准确度非常高(即 R2> 0.9),这可能表明训练和测试集之间的样本残留以及最终模型过度拟合。如果不以与测试相同的方式使用,过度拟合数据的模型在前瞻性研究中通常会显示低准确性。用于评估模型的测试集需要以代表其未来使用的方式对其进行挑战。例如,如果一个数据集由 10 个 API 构建,并且未来的使用不会超出这 10 个 API,那么随机数据拆分策略就足够了,因为所有 10 个 API 都将包含在训练和测试集中。但是,如果目标是训练模型以预测新 API 的结果,则在训练期间随机拆分不会引起过度拟合,并且在前瞻性使用新 API 时,该模型不会表现良好。在这种情况下,更好的方法是确保为模型训练适当拆分数据(例如,在 8 个 API 上训练并在 2 个前所未有的 API 上进行测试)。这将提供对模型实际性能的更好估计,并在测试集中的两个“未见”API 的测试期间突出任何过度拟合问题[31]。
研究内容
任何药物在供给临床使用前,为适应治疗或预防的需要而制成的药物应用形式,称为药物剂型,简称剂型。剂型预测,顾名思义就是指通过分析和比对不同剂型的特性(例如溶解度、平均粒径和比表面积),来预测抗拉强度、崩解,以及加速稳定条件对配方性能性能的影响,从而选择合适的剂型[32]。
当前一些候选药物的理化性质正朝着更高的分子量方向发展,同时,在寻求生物选择性和特异性的过程中,也具有更高的亲脂性。这些物理化学性质使化合物超越类药物规则(B-r-o-5)的化学空间,通常会导致其水溶解度较低。对于这类B-r-o-5化合物,通常需要采用非传统的给药策略(即传统片剂和胶囊制剂以外的制剂),以便在口服后达到充分暴露。制剂科学家可以在早期阶段借助工具评估不同的口服给药,从而找出合适的制剂策略;分子动力学模拟还提供了一个深入了解药物,配方和肠液之间的相互作用的途径;计算生物药物谱可用于识别非常规通道,如先导物优化和早期开发阶段的“配方能力”预测,从而增加口服可处理靶点的数量。这些制剂预测方法都将有助于药物制剂的发展[33]。
现有的剂型预测方法
目前投入工业应用的药物剂型预测产品主要有Protheragen公司开发的MedAI[18]和Coformula公司的人工智能工具[34]。
MedAI 支持人工智能驱动的配方平台,能够实现有针对性的、智能的新药候选。通过整合机器学习、深度学习、量子模拟和高通量实验,专家使配方科学家能够快速、全面和智能地开发临床差异化产品。药剂学和人工智能的跨学科整合可能会将药物研究的范式从依赖经验的研究转变为数据驱动的方法论。这些智能的工作方式从根本上改变了药物开发和药物产品生命周期管理,最终为患者带来更多优质的药物产品。人工智能方法,如人工神经网络 (ANN) 和深度学习策略,可以大大加快开发速度、优化配方、节省成本并保持产品的一致性[18]。

图15-6? MedAI药物制剂开发平台[18]
Coformula公司的产品能够了解活性药物分子和赋形剂之间的相互作用,并准确预测活性药物分子的顶级配方和比例。主要将药物结构或特性进行一系列数学变换后,通过独特的深度神经网络提取并运行多个特征。通过学习模式和相关性,Coformula 可以预测出最佳公式和参数[34]。
案例分析[25]
下面介绍澳门大学中医中华研究所联合科学技术学院发表的一篇文章。这是深度学习采用自动数据分割算法和适用于药物制剂数据的评估标准,首次被开发用于药物制剂的预测。
- 数据来源
药物数据集包括131个OFDF配方和145个SRMT配方。实验数据从Web of Science中提取。采用口腔快速溶解膜、口腔崩解膜和口腔分散膜三种不同的检索词检索OFDF制剂发展的文献。羟丙基甲基纤维素(HPMC)基缓释片基质配方的搜索策略为“HPMC”或“羟丙基甲基纤维素”或“羟丙基甲基纤维素”或“羟丙基甲基纤维素”与“片剂”或“片剂”。配方数据包括药物和辅料的类型和含量、工艺参数和剂型的体外特性。本研究选择了两种剂型的特性作为预测指标,包括OFDF的崩解时间和SRMT的累积溶出剖面(2、4、6和8 h)。用分子描述符表征原料药的性质。所有药物的名称均由分子量、XlogP3、氢键供体数、氢键受体数、可旋转键数、拓扑极性表面积、重原子数、复杂性和log等9个分子描述符描述。赋形剂的类型被编码成不同的数字。工艺参数包括:重量、厚度、抗拉强度、伸长率、折叠强度、OFDF和造粒工艺的实际药物含量、SRMT的直径、硬度。
- 实验方法
数据分割策略:使用了三数据集(训练/验证/测试数据集)的分割策略。训练集用于训练模型,验证集用于调优超参数以找到最优模型。测试集的准确性表明了对未知数据的预测能力。这种策略在机器学习中被广泛采用。对于每个剂型,将药物数据分成3个子集,验证集和测试集均包含20个剂型,其余数据用于训练模型。
机器学习方法的超参数:引入6种机器学习方法构建回归模型,与dnn进行比较,包括多元线性回归(MLR)、偏最小二乘回归(PLSR)、支持向量机(SVM)、神经网络(ann)、随机森林(RF)和k-最近邻(k-NN)。这些回归模型是使用scikit-learn软件包[35]进行训练的。对于OFDF, PLSR中,组件数设为8。在人工神经网络中,网络包含1个隐藏层和80个隐藏节点。在RF中,树的最大深度设置为3。在k-NN中,邻居数设置为5。对于SRMT,采用每种机器学习方法对4个模型同时训练4个时间点(2、4、6和8 h)。这4个模型是使用相同的超参数开发的。在PLSR中,组件的数量设置为10。在人工神经网络中,网络包含1个隐藏层和60个隐藏节点。在RF中,树的最大深度设置为5。在k-NN中,邻居数量k设置为3。
深度神经网络的超参数:使用DeepLearning4j机器学习框架(https://deeplear ning4j.org/)对深度神经网络进行训练。OFDF采用10层900个纪元的前馈神经网络。这个网络的每一层包含50个隐藏的神经元。SRMT采用9层2600个纪元的前馈神经网络。这个网络的每一层包含30个隐藏的神经元。所选择的所有网络都具有隐含层的激活函数和最后一层的s型激活函数。学习率为0.01。优化算法采用0.8动量的批量梯度下降法。
评估标准:在机器学习中,通常采用相关系数和决定系数作为回归问题的评价指标。相关系数表示两个变量之间的线性关系。决定系数显示了预测值与实际值之间的相关性。然而,相关系数和决定系数不能正确评估药物制剂预测模型的性能。在药剂学中,用于预测药物溶出曲线的良好模型的误差应小于10%[36]。因此,应引入适用于药剂学的特定标准来评估模型性能。
根据FDA(美国食品和药物管理局)的建议,使用相似因子f2来评估药物溶出度谱的相似度[36],引入相似因子f2来评估预测药物累积释放曲线模型的性能。如果f2大于等于50,则认为预测成功。累积释药曲线预测的准确性为所有预测中预测成功的百分比:
![]()
欧洲药典规定,分散片是应在3分钟(180 s)内分散的片剂。在我们的数据集中,OFDF的崩解时间范围为0至100 s。通常成功的预测是预测时间与实验时间之间的误差不大于10 s。崩解时间预测的准确性是所有预测中成功预测的百分比:
![]()
?式中,f0为预测值,f是实验值。

?图15-7? MD-FIS算法的工作流。
- 实验结果
在本研究中,基于配方数据建立了MLR、PLSR、SVM、ann、RF、k-NN和深度学习模型。本文采用MD-FIS算法对三个数据集进行了两次剖分,无需个人经验。在SRMT预测中,利用每种机器学习方法分别对4个时间点(2,4,6,8 h)建立4个模型。精度、均方根误差(RMSE)和平均绝对误差(MAE)的最终结果如下表所示。在OFDF预测中,对于所有基于线性或非线性传统机器学习方法的模型,在OFDF验证集和测试集上的准确率仅达到70%左右。在OFDF验证和测试集上,MLR模型的准确率相对较低。在SRMT的预测中,传统的机器学习模型对SRMT验证和测试集的预测精度在25% ~ 55%之间,远远不能满足公式开发的预期。综上所述,这六种传统机器学习方法都无法达到OFDF和SRMT公式预测的足够性能。

图15-8? 深度学习与传统机器学习方法的比较
在这里,用于训练 DNN 的训练、验证和测试集与用于训练之前机器学习模型的数据集相同。使用深度学习技术为 4 个时间点(2、4、6 和 8 小时)构建多标签模型。如图15-8所示,深度神经网络的预测准确率均在80%以上,可以满足配方预测的要求。在 OFDF 和 SRMT 预测中,深度学习在训练、验证和测试集上的准确率最高。深度学习超越了其他传统的机器学习方法,因为包含多个隐藏层的深度学习可以将低级表示转换为更高级别的特征,而无需人工特征工程。在 SRMT 预测中,发现深度学习比其他机器学习方法有巨大的性能改进。结果表明,深度学习可以极大地提高多标签公式预测中的模型准确性,因为深度学习可以利用多个任务之间的共享信息。图15-9a显示了OFDF测试集中制剂的实验和深度学习预测的崩解时间。图15-9b列出了SRMT测试集中制剂的实验和深度学习预测的累积药物释放曲线之间的f2值。从这些数字和表格可以看出,深度学习的预测性能是令人满意的。
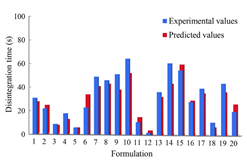 ?
?
图15-9? (a)在OFDF测试集中,通过实验和深度学习预测公式的崩解时间。 (b)实验与深度学习之间的f2值预测了SRMT测试集中处方的累积释药曲线。
本章寄语
本章介绍了人工智能对于药物制剂的一些辅助作用,主要介绍了晶型和剂型的预测方法和发展情况,我们也感受到了AI的神奇魅力。尽管如此,AI它不是神,到目前为止,它在医药领域只适合作为一个辅助工具,切勿盲目依赖,也请不要对AI工程师提出一些不切实际的要求。
其次,本章中涉及到的如第一性原理,密度泛函理论等,均属于计算物理,计算材料学范畴,若有兴趣可自行查阅学习。若是想要在该领域继续探索,建议把书中出现的工具动手操练一遍。计算的精髓在于动手。
最后,尽信书不如无书。笔者只是知识的搬运工,难免会有疏漏,若发现错误之处,欢迎指正。
参考文献
[18] PROTHERAGEN. MedAI [M].
[19] WLODEK S, SKILLMAN A G, NICHOLLS A. Automated ligand placement and refinement with a combined force field and shape potential [J]. Acta Crystallographica Section D, 2006, 62(7): 741-9.
[20] JANOWSKI P A, MORIARTY N W, KELLEY B P, et al. Improved ligand geometries in crystallographic refinement using AFITT in PHENIX [J]. Acta Crystallogr D Struct Biol, 2016, 72(Pt 9): 1062-72.
[21] SUN G, LIU X, ABRAMOV Y A, et al. Current State-of-the-art In-house and Cloud-Based Applications of Virtual Polymorph Screening of Pharmaceutical Compounds: A Challenging Case of AZD1305 [J]. Crystal Growth & Design, 2021, 21(4): 1972-83.
[22] ZHANG P, WOOD G P F, MA J, et al. Harnessing Cloud Architecture for Crystal Structure Prediction Calculations [J]. Crystal Growth & Design, 2018, 18(11): 6891-900.
[23] REILLY A M, TKATCHENKO A. Seamless and Accurate Modeling of Organic Molecular Materials [J]. The Journal of Physical Chemistry Letters, 2013, 4(6): 1028-33.
[24] 欧阳德方, 杨溢龙, 韩润, et al. 一种药物制剂预测方法 [M]. 2018.
[25] YANG Y, YE Z, SU Y, et al. Deep learning for in vitro prediction of pharmaceutical formulations [J]. Acta Pharmaceutica Sinica B, 2019, 9(1): 177-85.
[26] DAMIATI S A, MARTINI L G, SMITH N W, et al. Application of machine learning in prediction of hydrotrope-enhanced solubilisation of indomethacin [J]. International Journal of Pharmaceutics, 2017, 530(1): 99-106.
[27] IBRI? S, JOVANOVI? M, DJURI? Z, et al. The application of generalized regression neural network in the modeling and optimization of aspirin extended release tablets with Eudragit? RS PO as matrix substance [J]. Journal of Controlled Release, 2002, 82(2): 213-22.
[28] PETROVI? J, IBRI? S, BETZ G, et al. Optimization of matrix tablets controlled drug release using Elman dynamic neural networks and decision trees [J]. International Journal of Pharmaceutics, 2012, 428(1): 57-67.
[29] GHAFFARI A, ABDOLLAHI H, KHOSHAYAND M R, et al. Performance comparison of neural network training algorithms in modeling of bimodal drug delivery [J]. International Journal of Pharmaceutics, 2006, 327(1): 126-38.
[30] BARMPALEXIS P, KANAZE F I, KACHRIMANIS K, et al. Artificial neural networks in the optimization of a nimodipine controlled release tablet formulation [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2010, 74(2): 316-23.
[31] BANNIGAN P, ALDEGHI M, BAO Z, et al. Machine learning directed drug formulation development [J]. Advanced Drug Delivery Reviews, 2021, 175:113806.
[32] HAN R, YANG Y, LI X, et al. Predicting oral disintegrating tablet formulations by neural network techniques [J]. Asian Journal of Pharmaceutical Sciences, 2018, 13(4): 336-42.
[33] BERGSTR?M C A S, CHARMAN W N, PORTER C J H. Computational prediction of formulation strategies for beyond-rule-of-5 compounds [J]. Advanced Drug Delivery Reviews, 2016, 101:6-21.
[34] COFORMULA. Artificial Intelligence for Drug Formulation [M]. https://coformula.co/; Coformula. 2021.
[35] PEDREGOSA F, VAROQUAUX G, GRAMFORT A, et al. Scikit-learn: Machine learning in Python [J]. Journal of Machine Learning Research, 2011, 12:2825-30.
[36] SHAH V P, TSONG Y, SATHE P, et al. In vitro dissolution profile comparison- Statistics and analysis of the similarity factor, f2 [J]. Pharmaceutical Research, 1998, 15(6): 889-96